3D 세포 배양
3D 세포 배양(영어: 3D cell culture)은 세포가 3차원 환경과 상호작용하거나 성장할 수 있도록 인위적으로 만들어진 성장 환경을 의미한다. 2D 환경과 달리 3D 환경의 세포 성장은 세포로 하여금 생체 외 (In vitro)에서 모든 방향으로 성장할 수 있도록 하고, 그것은 생체 내 (In vivo)에서의 세포 환경과 더욱 유사하다. 이러한 3차원 세포배양은 일반적으로Bioreactor나 Cell을 Spheroids로 자라나게 할 수 있는 작은 캡슐에서 이루어진다. Bioreactor 하나당 대략 300개의 Spheroids들이 배양 될 수 있다.
배경 지식[편집]
세포배양이 접시(영어:Dish)에서 가능해지면서 생물분야에서 2차원배양이 생체내 현상을 연구하는 방법으로 많이 사용되어 왔다. 하지만 기존의 방법은 2차원(영어:2D)배양으로 한쪽 면은 접시에 붙어서 자라는 형태이므로 생체내에서 세포가 가지는 형태와 차이가 있다. 3차원(영어:3D)배양은 세포가 생체 내에서 가지는 형태 뿐만 아니라 세포가 자랄 때 가지는 환경과 유사하게 자랄 수 있게 하는 배양 방법이다. 2차원,3차원의 배양 방법의 차이는 세포의 형태와 유전자발현, 세포내 신호전달에서 차이를 보이고 3차원 배양이 생체내에서 일어나는 현상과 더 유사하다.[1]
3D 세포 배양의 최초 기록 중 하나는 20세기 초 AlexisCarrel가 장기간 생체외(In vitro) 조직 배양을 위한 방법을 개발하면서 시작되었다.[2]
또 다른 기록으로는 80년대 초기, Lawrence Berkeley National 연구소의 Mina Bissell팀은 정확한 생체외 배양 모델을 만들기 위한 3D 기술의 중요성을 강조하였다. 건강하고 암의 성격을 가진 유방 조직 모델을 만들기 위해 세포 세포외기질의 중요성과 생리학적으로 모사된 다세포 구조를 생성하기 위한 인공적인 3D 환경에서의 배양에 중점을 두었다.
이러한 기술은 약물의 영향을 평가하는 생체외(In vitro) 질병 모델 제작 기술에 적용되었다.[3]
1988년 Eric Simon의 NIH SBIR 보조금 보고서에서 Electrospinning(전기방사)가 시험관 내 세포 기질로 사용하기 위해 특별히 고안된 나노 및 서브마이크론 크기의 폴리스티렌 및 폴리카보네이트 섬유(현재는 Scaffolds로 알려짐)를 생산하는 데 사용되었다. 세포 배양 및 조직 공학을 위한 전기방사 섬유 격자의 초기 사용은 인간 포피 섬유아세포(Human Foreskin Fibroblasts,HFF), 형질전환된 인간 암종(Transformed Human Carcinoma,HEp-2) 및 밍크 폐 상피(Mink Lung Epithelium,MLE)를 포함한 다양한 세포 유형이 섬유에 부착되어 증식을 보여주었다. 2D 배양에서 일반적으로 볼 수 있는 평평한 형태와 대조적으로, 전기방사 섬유에서 성장한 세포는 일반적으로 둥근 3차원 형태를 가진다.[4]
가치[편집]
3차원배양은 생체내와 유사한 환경(세포-세포,세포-기질 상호작용,영양분 수송방법)을 만들어 세포를 배양할 수 있다. 3차원적으로 세포-세포 접촉이 일어나고 그에 따른 상호작용과 세포 분비물이 확산되면서 신호전달을 통해 세포막에 존재하는 수송단백질에 의해 약물이 농도에 따른 확산,투과로 세포에 들어가게 된다.[5] 따라서 3차원 배양을 통해 제작된 spheroids는 세포 이동 , 분화 , 생존 및 성장에 대해 2D 보다 개선된 모델이다.[6] 또한 3D 세포 배양은 2D에서 세포가 부분적으로만 분극될 수 있기 때문에 세포 분극을 보다 정확하게 묘사한다. 또한 3D로 성장한 세포는 2D로 성장한 세포와 다른 유전자 발현을 나타낸다.[7]
3차원 세포 성장은 세포 접착을 위해 더 많은 접촉 면적을 가지며 , 이는 Integrin ligation, 세포 수축 및 세포 내 신호 전달에 필요하다.[8][9] 정상적인 용질 확산 및 Effector proteins(예: 성장 인자 및 효소)에 대한 결합 반응도 3D 세포 기질과 연관 있으므로 조직 크기에 따른 용질 농도 구배 설정도 중요하다.[10]
이러한 특성은 2D에는 없고 3D배양에서만 일어나는 특성이다. 그래서 실제 생체에서 일어나는 약물대사과정이 2D배양에 비해 더 잘 일어나고 실제 생체내 현상과 유사한 현상을 3D배양에서 확인할 수 있다.[5]
마지막으로, 3D 세포 배양은 2D 세포 배양 보다 안정성이 더 높고 수명이 더 길다. 약물의 장기간 효과를 입증하는 등 장기간 연구에 더 적합하다. 3D배양 환경에도 세포가 방해 받지 않고 성장할 수 있다. 2D에서는 정상적인 세포 성장을 위한 충분한 영양소를 제공하기 위해 정기적인 트립신 처리를 하여 배양해야 한다.[11]3D Spheroid는 건강하고 Non-cancerous 성장을 유지하면서 최대 302일 동안 실험실 환경에서 배양 되었다.[12]
3D 세포 배양 방법의 분류[편집]
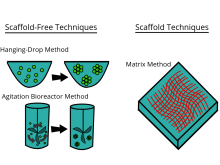
Scaffold 기법[편집]
생체내 세포는 세포외기질에 의해 둘러싸여 구조적으로 세포를 지지하거나 결합을 유지해준다. 이러한 세포외기질을 인공적으로 만들어 그 안에서 세포를 3차원배양하는 방법이다.
세포외기질을 만드는 재료종류,구조적방법에 따라서 나누어 질 수 있다.
Hydrogel[편집]
구조체(Scaffold)의 재료로 쓰이는 하이드로젤은 콜라젠,아가로즈 같은 천연하이드로젤과 PLGA로 이루어진 합성하이드로젤이 있다. 세포와 하이드로겔을 섞어서 접시에 분주하면 하이드로겔분자들 사이의 결합이 물에서 부풀면서 3차원 구조를 이룬다.이 구조안에서 세포가 3차원구조를 이루게 된다. 특정 전하,이온,온도에 의해 구조를 이루는 하이드로겔로 종류가 나누어 진다.[13]
오가노이드(Organoid)[편집]
메트리젤을 지지체로 사용하는 방법이다. 메트리젤은 세포외기질로 콜라겐-라미닌을 포함하는 점성이 높은 지지체이다. 성장인자들과 같이 오랜기간 배양하여 인체장기와 기능,모양이 유사한 장기유사체를 만드는 방법이다. 기존의 3차원 배양들과 다르게 장기들을 이루는 여러 세포들이 모여서 장기와 유사한 형태를 이룬다.
Scaffold-free[편집]
세포외기질 역할을 하는 구조체를 사용하지 않고 세포를 3차원 형태로 자라게 하는 방법이다.
Static suspension[편집]
2D에서는 세포를 바닥에 부착하여 기르는 형태인데 Static suspension은 세포가 바닥에 부착하지 못하도록 코팅한 방법이다. 코팅방법으로는 1.5% 한천을 접시에 코팅하여 부착하지 못하도록 하고 혈청을 넣지 않고 성장인자가 많은 배양액에서 부유세포를 3차원적으로 배양할 수 있는 방법이다.[14]
Spinner bioreactor culture[편집]
1970대에 Durand 와 Sutherland에 의해 고안된 방법으로 Spinner를 이용하여 세포를 계속해서 움직이게 하여 배양액에서 서로 친화성이 높은 세포들이 모여서 자라게 하는 방법이다. 많은 양의 균일한 세포 덩어리를 만들 때 사용하는 방법이다. 단점으로는 계속 움직이는 배양액에서 생기는 거품으로 인한 세포가 손상되는 점이 있다.[14]
Spheroids[편집]
Spheroids는 2차원 세포 모델에 비해 살아있는 세포의 환경 조건을 더 잘 모사하는 3차원 세포 모델로, 특히 세포 사이의 반응과 세포와 기질 사이의 반응을 나타낸다.[15] Spheroids는 세포의 생리학적 특성 변화, 건강한 세포와 종양 세포의 구조 차이, 종양 형성 시 세포에 일어나는 변화에 대한 연구에 유용하다.[16]Spheroid를 breast tumor cell과 fibroblast로 각각 제작한 후 공동배양을 통해 암세포가 정상 세포와 상호 작용하는 방식을 3D culture system을 통해 보여주었다.[17]
Spheroids 제작에 일반적인 방법은 세포 플레이트의 둥근 바닥에 응집체가 형성되는 회전 타원체 배양을 대량 생산하기 위해 Ultra low attachment 96well plate를 사용한다. U 또는 V모양을 가진 Well에 세포를 배양하면서 원심력을 이용하여 뭉치게 하는 방법이다.
또 다른 방법으로는 Hang in drop이 대표적인 방법이다. Hang in drop은 세포를 방울 형태로 거꾸로 매달아서 중력으로 인해 세포가 방울의 바닥 쪽으로 모여 spheroid를 이루는 방법이다. 단점으로는 방울이 떨어질 수 있고 한번에 10-20ul정도 밖에 만들지 못해 많은 양의 세포를 한 방울에 담을 수 없는 단점이 있다.[14]
최근, 일부 프로토콜은 균일하고 신뢰할 수 있는 Spheroids를 생산하기 위해 표준화되었다.[18]3D 세포 배양을 위한 표준화되고 경제적이며 재현 가능한 방법을 찾고자 했으며[19] Spheroid 실험의 재현성과 투명성을 향상시키기 위해 국제 컨소시엄에서 MISpheroID(Minimal Information in Spheroid Identity)를 개발했다.[20]
미세유체공학[편집]
사람 몸 안에서 다양한 세포 구조는 생존에 필요한 영양소와 가스 교환의 도움을 받기 위한 혈관을 형성되어야 한다. 유사하게, 시험관 내 3D 세포 배양은 특정 수준의 유체 순환을 필요로 하며, 이는 모두 영양소에 적절하게 노출되지 않는 3D 배양의 내부 구조는 문제가 될 수 있다.
이러한 조건은 특히 간세포 배양에서 중요하다. 왜냐하면 간은 혈관이 많이 발달된 기관이기 때문이다. 혈관 형성은 시험관 내에서 기능적 조직을 재구성하는 데 필수적이기 때문에 상피 조직과 미세혈관 사이의 3차원(3D) 상호 작용을 조사할 수 있는 모델이 필요하다. Microfluidic channels 사이에 있는 Collagen gel scaffold에서 간세포와 혈관 세포를 함께 배양하고 정지와 유동 환경에서 세포 성장을 비교했다. 결과적으로 조직과 미세혈관 네트워크가 있는 모델의 필요성을 보여줬다. 미세유체 플랫폼을 구축하여 3D 구조의 형성을 통해 세포-세포 응집과 세포-기질 접착 사이의 균형에 의해 제어된다는 것을 보여주었다. 장기적으로 시험관 내에서 여러 세포 유형이 있는 미세혈관 네트워크를 조사하는 데 유용하며, 궁극적으로 2D 배양 모델에서 실험 동물 모델에 이르는 생리학적 실험 모델뿐만 아니라 장기 교체에서 조직 공학 구조의 성공적인 임상 모델로 이어질 수 있다.[21]
약리학 그리고 독성학[편집]
약물대사는 주로 간에서 일어나고 CYP효소는 간에서의 약물대사에 중요하게 작용한다. 3차원 배양시 CYP450효소의 발현이 증가해서 약물대사가 2차원 배양보다 더 잘 일어난다. 3차원 배양은 2차원 배양에 비해 약물대사가 더 잘 일어날 뿐만 아니라 생체내와 유사하게 약물에 대한 저항성을 관찰할 수 있는 모델이다. 기존의 2차원 배양에서 효과를 보였던 약물들이 임상시험에 들어가면 효과를 보이지 않거나 매우 약하게 효과를 보여 사용할 수 없는 경우가 많았다. 3차원 배양은 약동학, 약력학적으로 생체내와 유사한 결과를 보이고 동물실험을 하지 않고도 어느정도 생체내에서 약물에 의한 독성과 효과를 유사하게 볼 수 있는 모델이다.[22] 그러므로 3D 배양을 이용하면 전임상 개발단계에서 임상시험이 들어가기전 유사한 효과를 볼 수 있기 때문에 임상에서의 실패율을 낮출 수 있어 천문학적 돈이 드는 임상시험을 들어가기전에 표적물질을 선택 할 때에 3D 배양의 중요성이 더 강조되고 있다. 예로 고형암인 간암의 경우 간암세포를 3D 배양을 6일정도 한 세포에 DNA 합성을 막는 약을 처리했을 때 2D 배양에서 나타나지 않았던 약물저항성이 나타났다.[23] 실제 암들은 약물의 저항성을 나타내기 때문에 2D배양보다 3D배양이 더 생체와 유사한 결과를 나타낸다고 할 수 있다.
암치료에 주로 사용하는 방사선치료기법은 암세포의 방산선에 대한 민감도가 매우 중요하다. 민감도는 산소의 분획도,세포들간의 신호전달 및 상호작용, 영양공급 상태에 따른 방사선조사선량에 따라 달라진다. 암세포의 경우 저산소 상태를 세포 안쪽에 가지고 영양분에 대한 대사도 다르다. 3D 모델을 이용하면 저산소상태(영어:Hypoxia),세포들간의 신호전달 및 상호작용을 자연적으로 유도가 가능 하기 때문에 항암치료 효과를 볼 수 있는 모델로도 적합하다.
고처리량 스크리닝[편집]
고밀도 형태를 갖춘 고처리량 스크리닝을 위한 3D 모델의 선도 기술 개발은 마이크로플레이트 밀도가 증가하면서 관련 성과로 인해 최근에 달성할 수 있었다 . 이들은 세포 방수제이고 비용 효율적이며 완전 자동화된 스크리닝 플랫폼에 적합한 384 및 1536웰 형식에서 발견되었다.[24] 1536웰을 제공하는 두 가지 옵션은 m3D Magnetic 3D 바이오프린팅을 사용하는 Greiner Bio-One[25]와 Ultra-low-attachment 표면 코팅한 Corning Life Sciences에서 사용하여 3D 모델을 만든다.[26][27]3D 스크리닝을 위해 개발된 신속하고 저렴한 방법 및 기술로 인해, 야생형에 비해 종양유전자 관련 돌연변이의 동종 쌍을 테스트하기 위한 유사한 고처리량 스크리닝 접근법이 가능하게 되었다.[28]
비판[편집]
3D배양을 하는 방법이 많이 개발되고 있지만 몇몇 배양은 Protocol의 표준화가 되어 있지 않다.
기존 3D 방법은 확장성, 재현성, 감도 및 HTS(고처리량 스크리닝)기기와의 호환성에는 제한이 없다. 세포 기반 HTS는 용량에 따른 세포 생존, 세포-세포, 세포-기질 상호작용, 세포 이동과 같은 약물 상호작용에 대한 세포의 반응을 측정하는데 이러한 분석법은 아직 3D 세포 배양에 최적화되어 있지 않다.[29]
또한, 3D 세포 배양 환경에서의 약물 상호 작용, 세포 분화 및 세포 신호 전달의 메커니즘과 상관 관계를 다루는 데이터의 양이 2D에 비해 많이 부족하다. 아직까지는 3D 방법 중 약물 개발 과정을 포함하여 대규모로 진행되는 2D 배양을 대체하지 못한다는 한계점을 가지고 있다.
ATP활성을 측정하는데 주로 사용하는 Luminescence assay, 세포활성을 측정하는 MTT assay는 2차원 배양에 비해 3D 배양은 덩어리로 존재해서 투과도가 낮고 시약확산이 다르기 때문에 2D에 비해 정확성이 낮다는 한계를 가지고 있다.
세포를 뭉쳐서 자라게 하는 Hang in drop과 같은 고정되지 않은 형태로 인해 실험자의 숙련도를 필요로 하는 작업이 많고 실험과정이 2차원 배양보다 어려워 많은 양을 생성하기가 어렵다는 단점이 있다. Scaffold 기법 중 Hydrogel의 경우에도 Media 교체과정 중 Hydrogel이 무너지는 문제도 존재한다.
각주[편집]
- ↑ Li, Grace N.; Livi, Liane L.; Gourd, Celinda M.; Deweerd, Elizabeth S.; Hoffman-Kim, Diane (2007년 5월). “Genomic and Morphological Changes of Neuroblastoma Cells in Response to Three-Dimensional Matrices”. 《Tissue Engineering》 13 (5): 1035–1047. doi:10.1089/ten.2006.0251. ISSN 1076-3279.
- ↑ Carrel, Alexis (1912년 5월 1일). “ON THE PERMANENT LIFE OF TISSUES OUTSIDE OF THE ORGANISM”. 《Journal of Experimental Medicine》 15 (5): 516–528. doi:10.1084/jem.15.5.516. ISSN 0022-1007. PMC 2124948. PMID 19867545.
- ↑ Kovner, Aliyah (2020년 3월 31일). “Mina Bissell Awarded International Prize for Her Contributions to Cancer Research” (미국 영어). 2022년 4월 26일에 확인함.
- ↑ Simon, Eric (1988년 5월 14일). 《NIH PHASE I FINAL REPORT: FIBROUS SUBSTRATES FOR CELL CULTURE (R3RR03544A)》.
- ↑ 가 나 Schyschka, L.; Sánchez, J. J. Martínez; Wang, Z.; Burkhardt, B.; Müller-Vieira, U.; Zeilinger, K.; Bachmann, A.; Nadalin, S.; Damm, G. (2013년 8월). “Hepatic 3D cultures but not 2D cultures preserve specific transporter activity for acetaminophen-induced hepatotoxicity”. 《Archives of Toxicology》 87 (8): 1581–1593. doi:10.1007/s00204-013-1080-y. ISSN 1432-0738. PMID 23728527.
- ↑ Griffith, Linda G.; Swartz, Melody A. (2006년 3월). “Capturing complex 3D tissue physiology in vitro”. 《Nature Reviews Molecular Cell Biology》 (영어) 7 (3): 211–224. doi:10.1038/nrm1858. ISSN 1471-0072.
- ↑ Pampaloni, Francesco; Reynaud, Emmanuel G.; Stelzer, Ernst H. K. (2007년 10월). “The third dimension bridges the gap between cell culture and live tissue”. 《Nature Reviews Molecular Cell Biology》 (영어) 8 (10): 839–845. doi:10.1038/nrm2236. ISSN 1471-0072.
- ↑ Suuronen, Erik J.; Sheardown, Heather; Newman, Kimberley D.; McLaughlin, Christopher R.; Griffith, May (2005). 《Building In Vitro Models of Organs》 (영어) 244. Elsevier. 137–173쪽. doi:10.1016/s0074-7696(05)44004-8. ISBN 978-0-12-364648-4.
- ↑ Louekari, Kimmo (2004년 10월). “Status and Prospects of In Vitro Tests in Risk Assessment”. 《Alternatives to Laboratory Animals》 (영어) 32 (4): 431–435. doi:10.1177/026119290403200416. ISSN 0261-1929.
- ↑ Knight, Brian; Laukaitis, Christina; Akhtar, Nasreen; Hotchin, Neil A.; Edlund, Magnus; Horwitz, Alan Rick (2000년 5월). “Visualizing muscle cell migration in situ”. 《Current Biology》 (영어) 10 (10): 576–585. doi:10.1016/S0960-9822(00)00486-3.
- ↑ Wrzesinski, Krzysztof; Fey, Stephen J. (2013). “After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver”. 《Toxicol. Res.》 2 (2): 123–135. doi:10.1039/c2tx20060k. ISSN 2045-452X.
- ↑ Wrzesinski, Krzysztof; Magnone, Maria Chiara; Hansen, Line Visby; Kruse, Marianne Ehrhorn; Bergauer, Tobias; Bobadilla, Maria; Gubler, Marcel; Mizrahi, Jacques; Zhang, Kelan (2013). “HepG2/C3A 3D spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation”. 《Toxicology Research》 (영어) 2 (3): 163. doi:10.1039/c3tx20086h. ISSN 2045-452X.
- ↑ Ruedinger, Ferdinand; Lavrentieva, Antonina; Blume, Cornelia; Pepelanova, Iliyana; Scheper, Thomas (2014년 11월 30일). “Hydrogels for 3D mammalian cell culture: a starting guide for laboratory practice”. 《Applied Microbiology and Biotechnology》 99 (2): 623–636. doi:10.1007/s00253-014-6253-y. ISSN 0175-7598.
- ↑ 가 나 다 Lv, Donglai; Hu, Zongtao; Lu, Lin; Lu, Husheng; Xu, Xiuli (2017년 10월 3일). “Three‑dimensional cell culture: A powerful tool in tumor research and drug discovery (Review)”. 《Oncology Letters》. doi:10.3892/ol.2017.7134. ISSN 1792-1074.
- ↑ Fennema, Eelco; Rivron, Nicolas; Rouwkema, Jeroen; van Blitterswijk, Clemens; de Boer, Jan (2013년 2월). “Spheroid culture as a tool for creating 3D complex tissues”. 《Trends in Biotechnology》 (영어) 31 (2): 108–115. doi:10.1016/j.tibtech.2012.12.003.
- ↑ Jiang, Yi; Pjesivac-Grbovic, Jelena; Cantrell, Charles; Freyer, James P. (2005년 12월). “A Multiscale Model for Avascular Tumor Growth”. 《Biophysical Journal》 (영어) 89 (6): 3884–3894. doi:10.1529/biophysj.105.060640. PMC 1366955. PMID 16199495.
- ↑ Kunz-Schughart, Leoni A.; Heyder, Paula; Schroeder, Josef; Knuechel, Ruth (2001년 5월). “A Heterologous 3-D Coculture Model of Breast Tumor Cells and Fibroblasts to Study Tumor-Associated Fibroblast Differentiation”. 《Experimental Cell Research》 (영어) 266 (1): 74–86. doi:10.1006/excr.2001.5210.
- ↑ Santi, Melissa; Mapanao, Ana Katrina; Cappello, Valentina; Voliani, Valerio (2020년 9월 14일). “Production of 3D Tumor Models of Head and Neck Squamous Cell Carcinomas for Nanotheranostics Assessment”. 《ACS Biomaterials Science & Engineering》 (영어) 6 (9): 4862–4869. doi:10.1021/acsbiomaterials.0c00617. ISSN 2373-9878. PMC 7735655. PMID 33395269.
- ↑ Tan, Loh Teng Hern; Low, Liang Ee; Tang, Siah Ying; Yap, Wei Hsum; Chuah, Lay Hong; Chan, Chim Kei; Lee, Learn Han; Goh, Bey Hing (2019년 1월 27일). “A reliable and affordable 3D tumor spheroid model for natural product drug discovery: A case study of curcumin”. 《Progress in Drug Discovery & Biomedical Science》 2 (1). doi:10.36877/pddbs.a0000017. ISSN 2710-6039.
- ↑ Peirsman, Arne; Blondeel, Eva; Ahmed, Tasdiq; Anckaert, Jasper; Audenaert, Dominique; Boterberg, Tom; Buzas, Krisztina; Carragher, Neil; Castellani, Gastone (2021년 11월). “MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity”. 《Nature Methods》 (영어) 18 (11): 1294–1303. doi:10.1038/s41592-021-01291-4. ISSN 1548-7105. PMC 8566242. PMID 34725485.
- ↑ Sudo, Ryo; Chung, Seok; Zervantonakis, Ioannis K.; Vickerman, Vernella; Toshimitsu, Yasuko; Griffith, Linda G.; Kamm, Roger D. (2009년 7월). “Transport‐mediated angiogenesis in 3D epithelial coculture”. 《The FASEB Journal》 (영어) 23 (7): 2155–2164. doi:10.1096/fj.08-122820. ISSN 0892-6638. PMC 2718841. PMID 19246488.
- ↑ Bokhari, Maria; Carnachan, Ross J.; Cameron, Neil R.; Przyborski, Stefan A. (2007년 8월 15일). “Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge”. 《Journal of Anatomy》 0 (0): 070816212604002–???. doi:10.1111/j.1469-7580.2007.00778.x. ISSN 0021-8782.
- ↑ Tanaka (2010년 9월 27일). “Analogy between sphere forming ability and stemness of human hepatoma cells”. 《Oncology Reports》 24 (5). doi:10.3892/or_00000966. ISSN 1021-335X.
- ↑ Baillargeon, Pierre; Shumate, Justin; Hou, Shurong; Fernandez-Vega, Virneliz; Marques, Nicholas; Souza, Glauco; Seldin, Jan; Spicer, Timothy P.; Scampavia, Louis (2019년 8월). “Automating a Magnetic 3D Spheroid Model Technology for High-Throughput Screening”. 《SLAS Technology》 (영어) 24 (4): 420–428. doi:10.1177/2472630319854337. PMC 7704036. PMID 31225974.
- ↑ Hou, Shurong; Tiriac, Hervé; Sridharan, Banu Priya; Scampavia, Louis; Madoux, Franck; Seldin, Jan; Souza, Glauco R.; Watson, Donald; Tuveson, David (2018년 7월). “Advanced Development of Primary Pancreatic Organoid Tumor Models for High-Throughput Phenotypic Drug Screening”. 《SLAS Discovery》 (영어) 23 (6): 574–584. doi:10.1177/2472555218766842. PMC 6013403. PMID 29673279.
- ↑ Madoux, Franck; Tanner, Allison; Vessels, Michelle; Willetts, Lynsey; Hou, Shurong; Scampavia, Louis; Spicer, Timothy P. (2017년 6월 1일). “A 1536-Well 3D Viability Assay to Assess the Cytotoxic Effect of Drugs on Spheroids”. 《SLAS Discovery》 (영어) 22 (5): 516–524. doi:10.1177/2472555216686308. ISSN 2472-5552.
- ↑ Quereda, Victor; Hou, Shurong; Madoux, Franck; Scampavia, Louis; Spicer, Timothy P.; Duckett, Derek (2018년 9월). “A Cytotoxic Three-Dimensional-Spheroid, High-Throughput Assay Using Patient-Derived Glioma Stem Cells”. 《SLAS Discovery》 (영어) 23 (8): 842–849. doi:10.1177/2472555218775055. PMC 6102052. PMID 29750582.
- ↑ Kota, Smitha; Hou, Shurong; Guerrant, William; Madoux, Franck; Troutman, Scott; Fernandez-Vega, Virneliz; Alekseeva, Nina; Madala, Neeharika; Scampavia, Louis (2018년 8월). “A novel three-dimensional high-throughput screening approach identifies inducers of a mutant KRAS selective lethal phenotype”. 《Oncogene》 (영어) 37 (32): 4372–4384. doi:10.1038/s41388-018-0257-5. ISSN 0950-9232. PMC 6138545. PMID 29743592.
- ↑ Antoni, Delphine; Burckel, Hélène; Josset, Elodie; Noel, Georges (2015년 3월 11일). “Three-Dimensional Cell Culture: A Breakthrough in Vivo”. 《International Journal of Molecular Sciences》 (영어) 16 (12): 5517–5527. doi:10.3390/ijms16035517. ISSN 1422-0067. PMC 4394490. PMID 25768338.
